Lo studio clinico EUPHORIA: Miglioramento di Ecografia e Fotoacustica per il Riconoscimento delle Anomalie Intestinali
Cosa é lo studio clinico EUPHORIA? (ClinicalTrials.gov identificatore NCT04456400)
La malattia infiammatoria intestinale (IBD) è una condizione cronica che rappresenta un carico significativo per i pazienti e il sistema sanitario. Le persone con IBD soffrono di un decorso recidivante di infiammazione intestinale e, ad oggi, non esiste una modalità diagnostica soddisfacente non invasiva per il monitoraggio dell’attività della malattia.
L’obiettivo dello studio clinico EUPHORIA è valutare la capacità di un nuovo dispositivo medico – il sistema MSOT Acuity Echo – di misurare l’attività della malattia infiammatoria nelle persone con malattia di Crohn (CD) o colite ulcerosa (UC). Per esaminare il valore di questa tecnologia, le prestazioni diagnostiche del sistema MSOT Acuity Echo verranno confrontate con altre valutazioni diagnostiche comunemente utilizzate, come l’endoscopia, l’ecografia, i valori del sangue e la risonanza magnetica.
Il sistema MSOT Acuity Echo (Figura 1) è a dispositivo non invasivo che utilizza una nuova modalità di imaging denominata Tomografia Optoacustica Multispettrale (MSOT). Questa tecnica combina l’illuminazione laser del tessuto con il rilevamento degli ultrasuoni: le molecole nei tessuti molli (come la parete del colon) assorbono la luce generata da un impulso laser trasmesso attraverso la sonda portatile, portando a un’espansione e contrazione del tessuto su scala molecolare. Ciò si traduce nell’emissione di onde ultrasoniche, che vengono rilevate dalla sonda e convertite in un’immagine con informazioni anatomiche, funzionali e molecularolari dell’area del corpo esaminata. Il processo di valutazione MSOT è simile a una valutazione ecografica addominale standard con un rilevatore ultrasonico portatile (Figura 2).
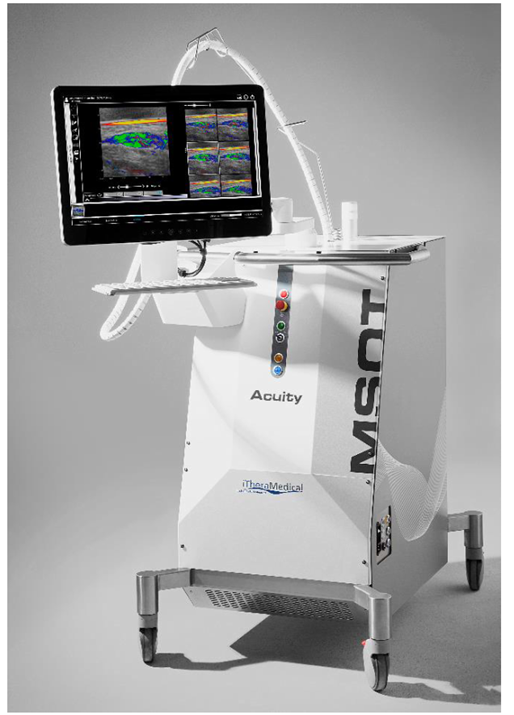
Figura 1: Il sistema MSOT Acuity Echo utilizzato in EUPHORIA
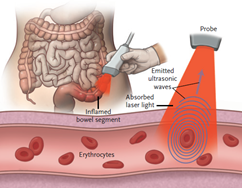
Figura 2: Principio dell’imaging MSOT addominale. L’illuminazione laser interagisce con le molecole presenti in natura nei tessuti molli per generare onde ultrasoniche, che vengono quindi rilevate dal trasduttore portatile.
Un precedente studio pilota che utilizzava la stessa tecnologia fondamentale nel sistema MSOT Acuity Echo ha dimostrato che il sistema può distinguere in modo non invasivo la malattia attiva dalla remissione. Sebbene questi primi risultati fossero incoraggianti, lo studio ha coinvolto solo una piccola coorte di 40 soggetti. Lo studio EUPHORIA intende confermare questi risultati con uno studio clinico multinazionale su larga scala sia in MC che in CU.
Per questo studio, si prevede di arruolare un totale di circa 540 partecipanti, circa la metà dei quali saranno pazienti con MC e metà con CU. Lo studio sarà suddiviso in 2 fasi; nella prima fase si determineranno i parametri ottimali che permettono la distinzione tra malattia attiva e remissiva. Nella seconda fase questi parametri verranno utilizzati per confermare l’accuratezza del dispositivo.
Cosa comporta la partecipazione?
Durante lo studio, i partecipanti vengono prima scelti e poi esaminati sia con MSOT che con valutazioni diagnostiche standard per IBD. Gli esami e le valutazioni saranno eseguiti dai medici di EUPHORIA. Un diagramma di flusso delle fasi dello studio clinico EUPHORIA illustra l’esperienza dei partecipanti (Figura 3). I singoli passaggi sono descritti in dettaglio più avanti.
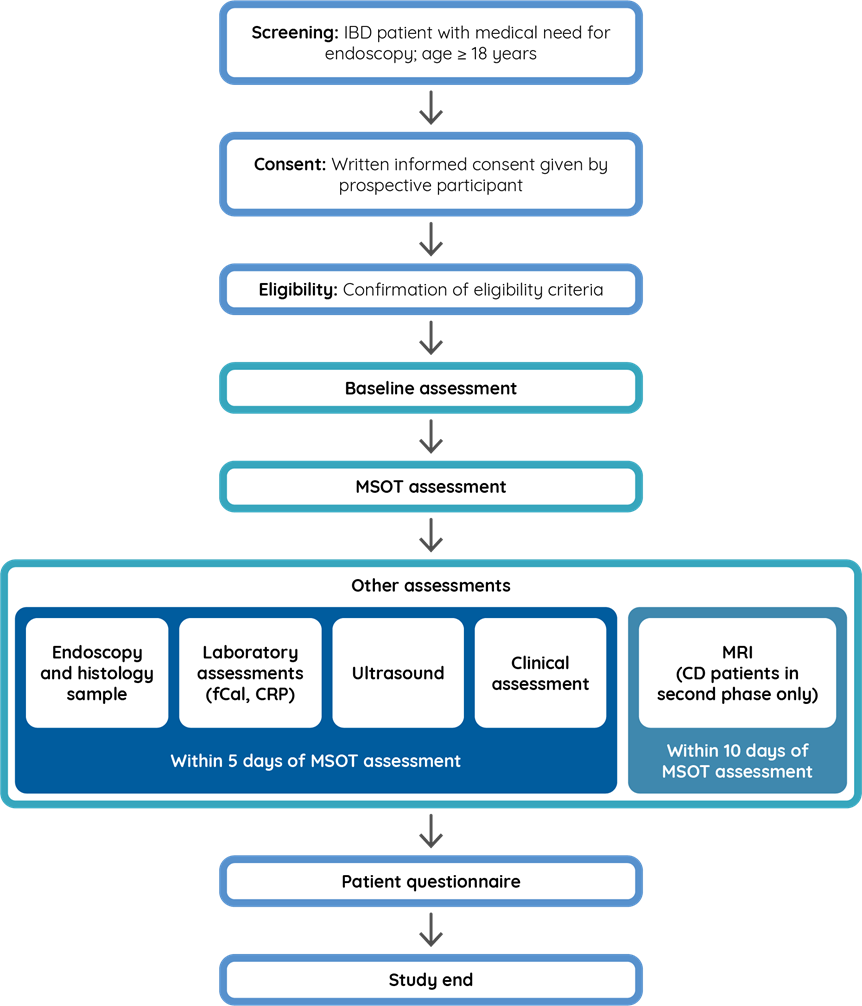 Figura 3: diagramma di flusso dello studio clinico EUPHORIA.
Figura 3: diagramma di flusso dello studio clinico EUPHORIA.
Screening, consenso e idoneità
In primo luogo, i pazienti vengono selezionati per la candidatura a partecipare al progetto EUPHORIA in base a condizioni note. I criteri includono una diagnosi confermata di IBD (CU o MC) e una tempestiva necessità medica di endoscopia.Dopo uno screening di successo per identificare i probabili potentiali partecipanti, i candidati vengono informati in dettaglio da un medico di ciò che comporta la partecipazione e di ciò che i partecipanti possono aspettarsi. I candidati interessati forniscono il consenso informato volontario – un prerequisito necessario prima che qualsiasi valutazione ed esame possa procedere.Una volta fornito il consenso informato, il medico esegue una verifica dell’idoneità alla partecipazione allo studio EUPHORIA. Ciò include la documentazione dei dati demografici dei pazienti, come l’età e il sesso. Potrebbero essere necessarie valutazioni aggiuntive per confermare l’idoneità. Tutte le valutazioni eseguite durante lo screening sono standard di cura.
Valutazione MSOT
Una volta dato il consenso del partecipante e confermata l’idoneità per lo studio, è possibile eseguire la valutazione MSOT. In generale, la valutazione MSOT è simile a una valutazione ecografica addominale standard con un rilevatore portatile, con l’eccezione che i partecipanti devono endossare occhiali di sicurezza laser protettivi.I partecipanti giacciono su un letto del paziente per l’esame, indossando occhiali di sicurezza laser forniti dal medico. In alcuni casi, la regione di interesse (pancia) potrebbe dover essere rasata se sono presenti peli, poiché i peli interferiscono con l’acquisizione dei dati MSOT. Per garantire una buona qualità dell’immagine, il gel per ultrasuoni viene applicato sulla sonda e sulla pancia prima della scansione. Il medico esegue la scansione della pancia più volte utilizzando la sonda per ottenere diverse immagini MSOT della parete intestinale (vedere la Figura 4).
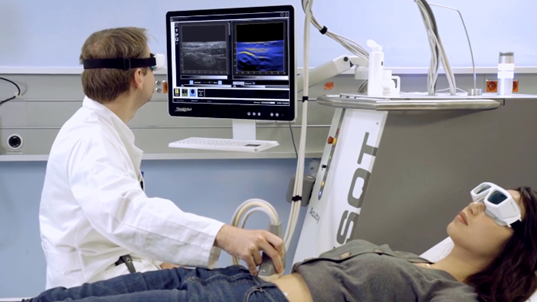
Figura 4: Valutazione della regione addominale con maging MSOT.
Vengono scansionate diverse regioni del colon. La fine dell’intestino crasso (colon sigmoideo) viene scansionata per tutti i partecipanti. L’estremità dell’intestino tenue (ileo terminale) viene anche scansionata nei pazienti con MC. Nei casi in cui è stata precedentemente eseguita una resezione chirurgica di questa regione, viene scansionata anche l’estremità neoterminale dell’intestino tenue (ileo neoterminale).Ogni regione viene sottoposta a scansione tre volte con due diverse impostazioni MSOT. In totale, la valutazione MSOT dura circa 15 minuti.
Altre valutazioni
Oltre alla valutazione MSOT, vengono eseguite anche le valutazioni diagnostiche che rappresentano lo standard di cura per i pazienti con IBD. Queste valutazioni includono l’ecografia addominale, la valutazione dell’attività clinica della malattia, il test del campione di sangue e di feci, l’istologia e l’endoscopia.Tutte queste valutazioni vengono eseguite lo stesso giorno della valutazione MSOT o durante le visite aggiuntive entro 5 giorni dalla valutazione MSOT.
Se tutte le valutazioni vengono eseguite entro un giorno o più giorni è determinato separatamente e individualmente per ogni partecipante e in consultazione con il medico.Per i pazienti affetti da MC nella seconda fase dello studio, viene eseguita una risonanza magnetica standard entro 10 giorni dalla valutazione MSOT. Ciò potrebbe richiedere al partecipante di tornare in ospedale per una visita aggiuntiva.Dopo il completamento di tutte le valutazioni diagnostiche, a ciascun partecipante viene chiesto di completare un questionario per valutare la propria esperienza con ciascuna valutazione eseguita su una scala a 5 punti e per fornire un feedback sulla propria impressione della scansione MSOT.Il paziente viene scansionato con il sistema MSOT Acuity Echo solo se decide volontariamente di partecipare allo studio. La scansione MSOT viene eseguita in aggiunta al consueto standard di cura dell’ospedale e nessuna decisione medica sarà basata sui risultati della scansione MSOT, indipendentemente dai risultati.
Chi può partecipare a questo studio clinico?
Lo studio è progettato per le persone con una diagnosi confermata di MC o CU nei casi in cui è richiesta l’endoscopia come utile valutazione dello stato della malattia.
Criteri
Criterio di inclusione:
- Età ≥ 18 anni
- Consenso informato scritto
- Necessità medica di endoscopia in base alle cure di routine dell’istituto di valutazione
- Diagnosi accertata di CU o MC da almeno tre mesi prima dell’arruolamento
Criteri di esclusione:
- Donne incinte o che allattano
- Ulteriori criteri di esclusione possono essere trovati qui: https://clinicaltrials.gov/ct2/show/study/NCT04456400.
Se un partecipante è registrato, cosa ci si aspetta da lui?
È importante che i pazienti partecipanti seguano le istruzioni dello studio sia per svolgere correttamente lo studio sia per la propria sicurezza. Le istruzioni per lo studio richiedono che ogni partecipante:
- Fornisce informazioni accurate relative al proprio stato di salute, ai farmaci che stà assumendo o ai sintomi che stà avendo.
- Mantiene gli appuntamenti per le visite.
È importante contattare il medico di EUPHORIA se il partecipante:
- È ricoverato o riceve cure in un ospedale.
- Sviluppa improvvisamente problemi di salute.
- Non desidera più partecipare allo studio.
- Modifica i dettagli di contatto.
Ad eccezione delle situazioni di emergenza, nuovi farmaci o dispositivi medici possono essere utilizzati solo dopo aver consultato il medico EUPHORIA del partecipante. Se i partecipanti sono in cura da altri medici, questi devono informare gli altri medici riguardo la loro partecipazione allo studio clinico EUPHORIA. Il medico EUPHORIA del partecipante deve anche essere informato di ogni trattamento medico che riceve da un altro medico durante la sua partecipazione allo studio clinico.
Chi ha avviato questo studio?
Questo studio è stato progettato da iThera Medical, il produttore del sistema MSOT Acuity Echo, e dal Prof. Maximilian Waldner, Investigatore Coordinativo dello studio clinico EUPHORIA. Lo studio è condotto da medici di vari ospedali. I costi di questo studio sono pagati da iThera Medical con il supporto del programma di ricerca e innovazione Horizon 2020 dell’Unione Europea attraverso il progetto EUPHORIA (con contratto di sovvenzione n. 830965).Lo studio EUPHORIA inizierà in ogni sito (sotto) una volta ottenuta l’approvazione etica e normativa per lo studio dalle autorità competenti.Ulteriori informazioni su questo studio sono disponibili in un elenco di studi clinici registrati su https://clinicaltrials.gov/ct2/show/study/NCT04456400. Al completamento dello studio clinico EUPHORIA, questo sito Web visualizzerà un riepilogo dei risultati dello studio.
Chi posso contattare per partecipare?
Site 01:
Prof. Dr. med. Maximilian Waldner
Universitätsklinikum Erlangen
Medizinische Klinik 1
Ulmenweg 18, 91054 Erlangen
Germany
Study Coordinator:
Dr. med. Daniel Klett
E-Mail:
Phone: +49 9131 85-45039/-35204
Site 02:
Prof. Dr. Andreas Stallmach
Universitätsklinikum Jena
Klinik für Innere Medizin IV
Am Klinikum 1, 07747 Jena
Germany
Study Coordinator:
Dr. rer. nat. Anja Schauer
E-Mail:
Phone: +49 3641-9324582
Site 03:
Mariangela Allocca, MD, PhD
Centro per la Ricerca e la Cura delle Malattie Infiammatorie Croniche Intestinali
IRCCS Humanitas
via Manzoni 56, 20089 Rozzano (MI)
Italy
Study Coordinator:
Daniela Gilardi, PharmD
E-Mail:
Phone +39 02 8224 7303
Site 04:
Prof. Giovanni Monteleone
Policlinico Tor Vergata
UOC di Gastroenterologia
Viale Oxford n. 81 – Roma (00133)
Italy
Study Coordinator:
Dr. Elvira Scalera
E-Mail:
Site 05:
PI: Dott. ssa Mariangela Allocca
IRCCS Ospedale San Raffaele
IBD unit -Dipartimento di Gastroenterologia ed Endoscopia digestiva
Via Olgettina 60
20132, Milano, Italy
Study Coordinator: Carmen Di Matteo
Phone: +39 2 2643 2069
Site 06:
PI: Prof. Dr. Britta Siegmund
Charité – Universitätsmedizin Berlin
Campus Benjamin Franklin
Klinik für Gastroenterologie, Infektiologie und Rheumatologie
Hindenburgdamm 30
12203 Berlin, Germany
Study Coordinator:
Patricia Schaafs
Phone: +49 30 450 614 876
Nota: il sommario di cui sopra è solo un’informazione generale sullo studio e non dovrebbe essere invocato in nessun caso individuale. Prima di decidere di partecipare allo studio, a ciascun candidato interessato verranno fornite informazioni dettagliate sullo studio in modo che possa prendere una decisione consapevole volontaria se partecipare o meno. Possono partecipare solo i candidati idonei a partecipare allo studio e che forniscono il consenso informato. La partecipazione può essere possibile nei siti solo fino a un certo numero massimo di partecipanti.

